Propuesta de norma para que los pacientes puedan identificar claramente los medicamentos, especialmente los que tienen la misma composición pero distintos nombres y aspectos que llevan a confusión.
El aspecto de los medicamentos, desde el tamaño y diseño de las cajas y blísteres hasta la forma, tamaño, color e impronta de los comprimidos o cápsulas, sirve a los pacientes para identificarlos y evitar confusiones a la hora de tomarlos.
Tras la aparición de las especialidades farmacéuticas genéricas (EFG), el número de marcas que ofrecen el mismo principio activo con diferentes aspectos y nombres ha proliferado notablemente.
Sucesivos decretos-leyes posibilitan la sustitución a los pacientes de los medicamentos que toman por otros de igual composición pero diferente marca, dentro de una horquilla de precios de referencia 1, 2.
Todo lo anterior supone que cada vez que el paciente acude a la farmacia en busca de su medicación puede recibir una caja diferente, con blísteres, comprimidos o cápsulas de aspecto diferente, y también con un nombre distinto. Las posibilidades se cuentan por decenas en el caso de algunos fármacos, precisamente los de más uso. Si el paciente toma más de un medicamento, las diferentes combinaciones de cajas que puede recibir cada vez son centenares de miles 3.
Estos cambios quiebran la importante barrera antierrores que constituye el conocimiento del aspecto y el nombre de los medicamentos, tanto para los profesionales y cuidadores que dan la medicación como para los pacientes. Roto este valioso recurso de identificación, aumentan los errores, los daños consecuentes, a veces con desenlaces fatales, las visitas a urgencias y las hospitalizaciones 4, 5.
Los pacientes con problemas de salud mental, deterioro cognitivo, déficit de agudeza visual, bajo nivel educativo y de lectura o los polimedicados son los más vulnerables. Los ancianos con frecuencia combinan varios de estos factores de riesgo 6, 7.
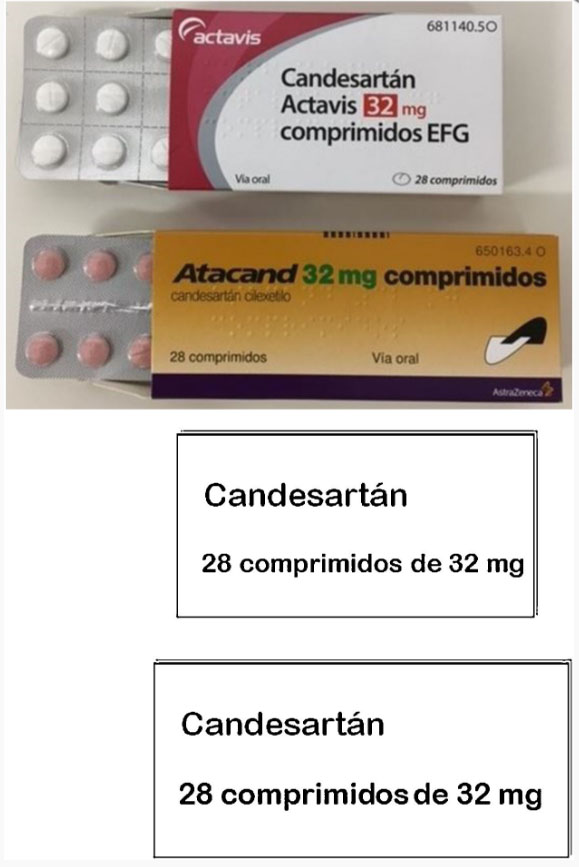
Pero cualquier paciente, ante dos cajas tan diferentes como las de la figura 1, puede penar erróneamente que son distintos fármacos o bien que se ha añadido un medicamento nuevo al tratamiento y tomar un comprimido de cada caja, con resultado de sobredosis y sus efectos adversos consiguientes.

Incluso entre los profesionales se dan errores de identificación entre marcas de nombres y aspectos diferentes.
El cambio en la apariencia y en el nombre de la medicación puede generar también desconfianza en los pacientes, con disminución de su efectividad, aparición de reacciones adversas que no sufrían anteriormente o discontinuidad de la adherencia al tratamiento 8, 9.
Para paliar los riesgos creados por los cambios de nombre y apariencia, la Sociedad Española de Medicina Familiar y Comunitaria (semFYC), la Federación de Asociaciones de Enfermería Comunitaria y Atención Primaria (FAECAP) y la Sociedad Española de Calidad Asistencial (SECA) propusieron en 2011 una medida de mejora de la identificación de la medicación 10. Se trata de una redistribución del contenido que obligatoriamente ha de figurar en las cajas, dejando en al menos una de las caras principales exclusivamente la composición (denominación oficial española), la dosis, el número de dosis y la forma farmacéutica, en letras claramente legibles. Para el principio activo de las marcas de la parte superior de la figura 1, las cajas quedarían como se ve en la parte inferior de dicha figura.
En el resto de las caras del envase externo se mantendría el diseño del fabricante.
Esta propuesta facilitaría la identificación de la medicación, tanto a los profesionales como a los cuidadores y a los pacientes. Simplemente poniendo las cajas de los medicamentos que toma el paciente con esta cara a la vista se podrían detectar duplicidades y comprobar si toma exactamente lo que tiene prescrito, sin errores ni por defecto ni por exceso. Vueltas las cajas de la figura 1, por ejemplo, sería fácil identificar que ambas contienen el mismo principio activo a idéntica dosis.
La propuesta es sencilla y factible, ya que no precisa de cambios en la ley que regula el envasado de los medicamentos, pues la norma ya recoge que han de aparecer principio activo, dosis, número de dosis y forma. Lo único que se propone es reordenar los contenidos en la caja 11.
Esta propuesta, que recibió amplio apoyo en su día, vuelve a estar de máxima actualidad por el hecho de que, a partir de 9 de febrero de 2019, las compañías farmacéuticas han de reimprimir las cajas de todos los medicamentos, en aplicación de la nueva normativa de la Unión Europea para dificultar las falsificaciones 12. Una oportunidad única de introducir esta medida de prevención de errores a un coste cero. Por ello, a las sociedades científicas ya mencionadas de medicina, enfermería y calidad, semFYC, FAECAP y SECA, se ha unido la Sociedad Española de Farmacéuticos de Atención Primaria (SEFAP) para demandar conjuntamente que se implemente esta medida.
Para ello el Ministerio de Sanidad, Servicios Sociales e Igualdad ha de promulgar una norma para que, a la vez que se imprime el código de seguridad antifalsificaciones, se introduzca esta medida de seguridad antierrores, compatible tanto con la normativa vigente española como con la europea.
Debemos aprovechar esta oportunidad para evitar a los pacientes daños por errores de identificación, a veces con desenlace fatal. Se trata de eventos adversos prevenibles, por lo que la bioética obliga a actuar. Es una medida de mejora de la seguridad del paciente sin un coste añadido público o privado: actualmente solo se requiere la voluntad política de implementarla.

Artículo Publicado en la Revista Atención Primaria
Bibliografía
- Medidas para la mejora de la calidad y cohesión del sistema nacional de salud, de contribución a la consolidación fiscal, y de elevación del importe máximo de los avales del Estado para 2011. Real Decreto-ley 9/2011, de 19 de agosto. Boletín Oficial del Estado, n.° 200 (20 de agosto de 2011). Disponible en: https://www.boe.es/boe/dias/2011/08/20/pdfs/BOE-A-2011-14021.pdf
- Medidas urgentes para garantizar la sostenibilidad del Sistema Nacional de Salud y mejorar la calidad y seguridad de sus prestaciones. Real Decreto-ley 16/2012 de 20 de abril. Boletín Oficial del Estado, n.° 98 (24 de abril de 2012). Disponible en: https://www.boe.es/diario_boe/txt.php?id=BOE-A-2012-5403
- Sano y salvo: 4 medicamentos, 811.800 posibles aspectos diferentes [Internet]. Sano-y-salvo.blogspot.com.es. 2011 [consultado 9 May 2016]. Disponible en: http://sano-y-salvo.blogspot.com.es/2011/10/4-medicamentos-811800-posibles-aspectos.html
- J. Palacio Lapuente,A. Villafaina Barroso,E. Gavilán Moral
Isoapariencia: si son iguales, que parezcan iguales
AMF, 12 (2016), pp. 445-451 - J.L. Lenahan,D.M. McCarthy,T.C. Davis,L.M. Curtis,M. Serper,M.S. Wolf
A drug by any other name: Patients’ ability to identify medication regimens and its association with adherence and health outcomes
J Health Commun., 18 (2013), pp. 31-39 http://dx.doi.org/10.1080/10810730.2013.825671
Medline - Institute for Safe Medication Practices. Oral solid medication appearance should play a greater role in medication error prevention. 2011; 28 July. Disponible en: http://www.ismp.org/NEWSLETTERS/ACUTECARE/articles/20110728.asp
- K. Notenboom,E. Beers,D.A. van Riet-Nales,T.C. Egberts,H.G. Leufkens,P.A. Jansen
Practical problems with medication use that older people experience: A qualitative study
J Am Geriatr Soc., 62 (2014), pp. 2339-2344 http://dx.doi.org/10.1111/jgs.13126
Medline - A.J. De Craen,P.J. Roos,A. Leonard de Vries,J. Kleijnen
Effect of colour of drugs: Systematic review of perceived effect of drugs and of their effectiveness
BMJ., 313 (1996), pp. 1624-1626
Medline - A.S. Kesselheim,K. Bykov,J. Avorn,A. Tong,M. Doherty,N.K. Choudhry
Burden of changes in pill appearance for patients receiving generic cardiovascular medications after myocardial infarction: Cohort and nested case-control studies
Ann Intern Med., 161 (2014), pp. 96-103 http://dx.doi.org/10.7326/M13-2381
Medline - F. Palacio Lapuente,M.A. Hernández Rodríguez
Isoapariencia. Una necesidad imperiosa en la prescripción por denominación oficial española
Aten Primaria, 43 (2011), pp. 625-626 http://dx.doi.org/10.1016/j.aprim.2011.11.001
Artículo | Medline - Real-decreto 1345/2007, de 11 de octubre, por el que se regula el procedimiento de autorización, registro y condiciones de dispensación de los medicamentos de uso humano fabricados industrialmente [consultado 15 Jun 2017]. Disponible en: http://www.boe.es/boe/dias/2007/11/07/pdfs/A45652-45698.pdf
- Reglamento Delegado (UE) 2016/161 de la Comisión, de 2 de octubre de 2015, que completa la Directiva 2001/83/CE del Parlamento Europeo y del Consejo estableciendo disposiciones detalladas relativas a los dispositivos de seguridad que figuran en el envase de los medicamentos de uso humano. Diario Oficial de la Unión Europea. 2016. Disponible en: http://eur-lex.europa.eu/legal-content/ES/TXT/PDF/?uri=CELEX: 32016R0161&from=ES
Autor para correspondencia. (Jesús Palacio jepala@gmail.com)